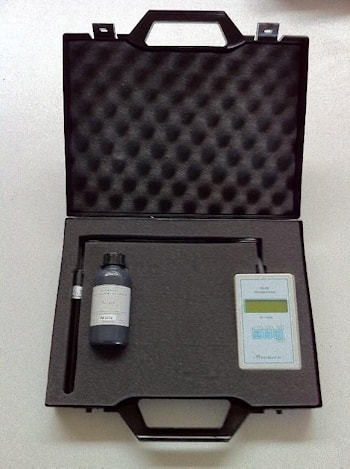
Калибровочные растворы электропроводности (EC) и концентрации кислоты (pH)
 Калибровочные буферные растворы применяются для проверки и калибровки приборов измерения рН и Ес ( ЕРН 119, ЕС-93 , РН-95 и других). Также эти жидкости применяются для калибровки приборов, для калибровки датчиков ЕС и рН на установках капельного орошения и прочем оборудовании, где установлены датчики.
Калибровочные буферные растворы применяются для проверки и калибровки приборов измерения рН и Ес ( ЕРН 119, ЕС-93 , РН-95 и других). Также эти жидкости применяются для калибровки приборов, для калибровки датчиков ЕС и рН на установках капельного орошения и прочем оборудовании, где установлены датчики.Основные данные:
Калибровочный раствор рН4.0 объем банки 250мл/ 500мл/ 1000мл.
Калибровочный раствор рН7.0 объем банки 250мл/ 500мл/ 1000мл.
Калибровочный раствор рН10.0 объем банки 250мл/ 500мл/ 1000мл.
Калибровочный раствор ЕС4.0 объем банки 250мл/ 500мл.
Калибровочный раствор ЕС1.413 объем банки 500мл/ 1000мл.
и другие по запросу
В наличии: есть
Кроме указанных растворов в наличии постоянно имеется раствор KCL для хранения электродов рН объемом 250 мл.
Информация для справки:
ЕС (электропроводность) – это математическая оценка способности раствора проводить электрический ток. Она зависит, в основном, от степени минерализации исследуемого раствора и его температуры. Удельная электропроводимость используется для оценки общего количества растворенных в воде твердых веществ.
Рассматривая конкретно воду, которая представляет собой растворы смесей сильных и слабых электролитов: минеральную часть воды составляют ионы натрия, калия, кальция, сульфата (SO4,2-), гидрокарбоната,- можно заключить, что именно этими ионами обусловлена электропроводность воды. Наличие таких ионов как двух- и трехвалентного железа, марганца, алюминия, нитрата, и т.п. не оказывает сколько-нибудь серьезного влияния на электропроводность (если, конечно же, эти ионы не содержатся в воде в значительном количестве). Электропроводность не нормируется, но величина 2000 мкС/см примерно соответствует общей минерализации в 1000 мг/л.
pH - это водородный показатель, характеризующий концентрацию свободных ионов водорода в воде. Если говорить проще, то величина рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН-, то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Очень часто показатель рН путают с такими параметрами, как кислотность и щелочность воды. Важно понимать разницу между ними. Главное заключается в том, что рН - это показатель интенсивности, но не количества. То есть, рН отражает степень кислотности или щелочности среды, в то время как определение кислотности и щелочности характеризует количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Например, опустив руку в воду, мы можем сказать какая вода - прохладная или теплая, но при этом не сможем определить сколько в ней тепла (т.е. условно говоря, как долго эта вода будет остывать).
Если вы хотите купить калибровочные растворы электропроводности (EC) и концентрации кислоты (pH) , вы можете:
Позвонить: